本报告由农驰宝大数据独家原创
如要转载,请联系本文作者,否则一律举报!
一、GLP认证的起源
GLP是“Good Laboratory Practice(良好实验室规范)”的简称。

1972年,新西兰最早进行了GLP立法,要求所有进行科学实验研究的实验进行注册,没有达到GLP标准的实验室,其数据不得与他人进行交换,在法律上无效。1973年丹麦提出国家实验理事会法案,和GLP法规相似。1976年,美国开始试行GLP后, 在美国的带动下,英国(1982年)、日本(1982年)、法国(1983年)、瑞典(1985年)、西班牙(1985年)、荷兰(1986年)、意大利(1988年)、比利时(1988年)、以及德国、加拿大和瑞士等国先后发布了本国的GLP,GLP逐渐成为国际上通行的确保药品非临床安全性研究质量的规范。
其后,GLP的概念逐渐扩展到其他有毒有害物质(农药、兽药、化妆品、食品和饲料添加剂等)。因此,可以说目前GLP的范围已经覆盖了与人类健康有关的所有实验室研究工作,并有进一步向与整个环境和生物圈有关的实验室研究工作扩展的趋势。
二、OECD-GLP的目的和适用范围
试验方案和标准的不同,往往会成为化学品国际贸易的壁垒,OECD成员国一直致力于试验方法和GLP的国际协调和认可;GLP的目的是促进数据质量的提高,而试验数据的可比性是各国之间数据互认的基础。一个国家可以完全认可和信赖在其他国家获得的数据,就可以避免重复试验,节省时间和资源,进而更好地保护人类健康和环境安全;
OECD(1982)列出了GLP准则包括的试验内容:理化性质;评价对人类健康效应的毒理学试验(短期及长期试验);评价对环境效应的生态毒理学试验(短期及长期试验);化学品环境行为的生态学研究(残留、光解、植物代谢、土壤代谢、作物吸收与运转、土壤消解、微环境影响、生物富集、非靶生物效应等);为确定最大残留量和食品中的接触量而进行的农药残留、代谢物与相关化合物定性和定量检测也包括在生态学试验中。OECD对GLP在田间试验中的应用、短期试验(无法明确定义)中的应用,多场所试验、以及在离体生物试验(多属于短期试验)中的应用都有相应规定。
三、中国GLP实验室建设和资料互认
根据2008年6月1日开始实施的欧盟REACH法规的相关规定,进入欧盟市场的所有化学品必须在规定的时间内凭GLP实验室出具的安全性评价数据到相关部门登记注册,方可在欧洲市场销售。为服务于我国的出口贸易,使我国产品在国内即可获得GLP实验室的检测服务,按照国际通行原则建立我国的GLP实验室监控体系,国家认监委从2008年3月开始组织开展GLP实验室评价试点工作。
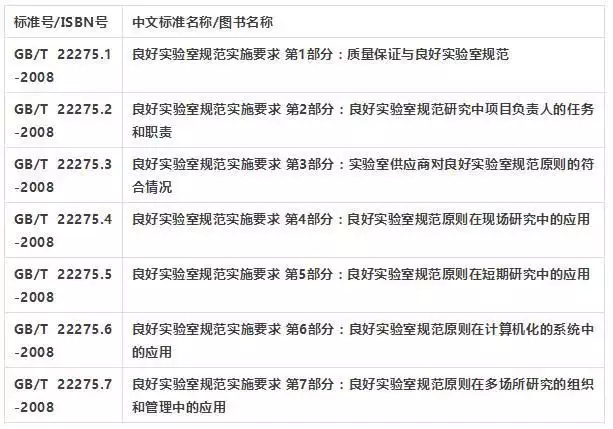
中国国家认证认可监督管理委员会(Certification and Accreditation Administration of the People‘s Republic of China)负责GLP实验室认证工作。并已经制定发布了有关规则和指导:《良好实验室规范(GLP)原则》(试行);《良好实验室规范(GLP)符合性评价程序》(试行);《良好实验室规范(GLP)符合性评价申请书》(试行);《国家认监委良好实验室规范(GLP)评价的领域》(试行)。表7-3是良好实验室规范(GLP)原则的主要内容。下表是国家认监委良好实验室规范(GLP)的评价领域。
国家认监委良好实验室规范(GLP)评价领域(试行)

中国国家认证认可监督管理委员会开始GLP认证工作并于2008年12月首次批准第一家GLP实验室(上海化工研究院检测中心)。在此之前,中国目前已经有一家农药产品化学方面的民营实验室,获得比利时认证机构的第三方认证,成为我国首家民营GLP实验室。
农业部农药检定所多年来积极推进GLP实验室认证工作,并在申请以非OECD成员国的身份加入OECD的GLP资料互认体系,但目前尚无结果。南非、斯洛文尼亚、以色列、印度、新加坡和巴西都已经以非OECD成员国的身份加入到OECD的GLP资料互认体系。
农业部农药检定所农药GLP实验室认证工作取得主要进展包括: 发布了农药毒理学安全性评价良好实验室规范(NY/T 718-2003);农药理化分析良好实验室规范准则(NY/T 1386-2007);和《农药良好实验室考核管理办法》(试行)。
四、GLP与实验室合格评定的区别
1、依据不同:我国的合格评定依据的是ISO/IEC 17025, 而GLP实验室认证依据的是OECD的GLP准则(OECD GLP principles);
2、适用范围不同:合格评定包括实验室检验和校准,范围很广,也包括毒理学、化学检验、医学检验等;而GLP主要是用于医药、农药、兽药、食品/饲料添加剂、化妆品、工业化学品等的产品化学、毒理学、环境行为和环境毒理、残留、药效等方面),其对于项目特异性的要求较强。
